【Coord.Chem.Rev】近红外光疗纳米材料
NIR
近红外
肿瘤光疗的原理
简述
癌症,这一全球肆虐的恶性疾病,以其高发病率与死亡率,对人类健康构成了严峻挑战。据美国癌症协会最新预测,2023年,美国境内将新增癌症病例高达1,958,310例,并有609,820人将不幸因癌症离世。鉴于此,癌症治疗不仅是一项全球性任务,更是对社会福祉的深刻影响。当前,临床实践中主要依赖手术、化学疗法及放射疗法作为抗癌手段。然而,这些方法常因复发风险高、副作用显著及全身毒性等问题,其疗效往往难以达到理想状态,尤其是手术对于中晚期已发生转移的肿瘤,其治疗效果尤为有限。此外,即便微小至单个的癌症干细胞残留,亦可能重新激发肿瘤生长。化疗药物在长期应用中则易引发耐药性,限制其持续疗效;而放疗虽为常规治疗手段,却也不可避免地对周边健康组织造成一定损伤。因此,探索更为安全、高效的肿瘤治疗新技术显得尤为迫切。
光疗,作为一种非侵入性治疗手段,在肿瘤治疗领域展现出了巨大潜力,其高效性、高选择性和低耐药性特点,正逐步成为研究热点。光疗主要包括光热疗法(PTT)与光动力疗法(PDT)两大分支。PTT利用光热转换剂(PTA)将光能转化为热能,局部升温以直接消融肿瘤细胞;而PDT则依赖于光敏剂(PSs)在特定波长光照下激发分子氧生成细胞毒性活性氧(ROS),通过氧化应激机制杀伤癌细胞。PDT作为光疗的经典代表,已在临床实践中应用了四十余年,自1993年卟啉钠作为首代PS获批用于治疗复发性浅表乳头状膀胱癌以来,多种PS已被成功应用于前列腺癌、皮肤癌及食管癌等多种实体瘤的治疗中。
鉴于肿瘤微环境(TME)的复杂特性,光疗对激发光的高穿透性提出了严格要求。传统可见光因穿透深度不足而受限,相比之下,近红外(NIR)光因其对生物组织(如蛋白质、黑色素、血红蛋白、胶原蛋白及水)的低吸收性,成为光疗的理想光源,能有效减少脱靶效应,提升治疗精准度与效果。因此,近红外光治疗剂备受瞩目,其应用不仅能减少手术需求,缩短康复周期,保护器官功能,还能显著降低局部与全身治疗的复发率。
尽管传统光疗已步入临床应用,但肿瘤深度、药物靶向性及毒性控制等问题仍制约其疗效的进一步提升。为此,光治疗剂的分子设计与结构优化成为关键突破点。纳米技术的飞速发展,为新型光治疗纳米粒子(NPs)的研发开辟了新途径。纳米药物凭借其高比表面积与纳米尺度效应,能更有效地通过肿瘤组织的增强渗透与滞留(EPR)效应实现局部蓄积,并通过能量依赖的内吞作用进入肿瘤细胞,从而在降低药物剂量、耐药性及副作用的同时,最大化光疗效果。然而,单光疗模式因光的穿透深度限制、活性氧快速耗散及热休克蛋白(HSPs)耐热性等固有缺陷,往往难以达到理想疗效。
为解决这一问题,非侵入性光疗与其他治疗手段的联合应用应运而生,为肿瘤治疗提供了更为全面、高效的解决方案。联合疗法不仅能够增强各治疗手段的协同效应,使整体疗效远超单一疗法之和,还能通过优化给药效率、加速药物释放等途径,弥补光疗的不足之处,共同激发最大的治疗效果。这一创新策略,无疑为肿瘤治疗领域带来了新的曙光。
在这篇综述中,我们将全面介绍近红外光疗纳米材料的最新进展及其在精确癌症单一疗法中的应用。为了总结癌症光疗的最大治疗应用并概述其在癌症治疗中的潜在功能,我们还集中介绍了纳米材料与其他治疗方法(如化疗、放疗、免疫疗法、抗血管生成疗法、声动力学疗法、气体疗法、基因疗法和饥饿疗法)的联合光疗。此外,还综述了光治疗剂的智能改性。此外,还介绍了用于癌症治疗的光治疗剂的实际临床案例。最后,我们对光疗在癌症治疗及其临床应用方面的当前挑战和未来前景进行了公正的概述。
历史
光疗法在医学领域的应用可追溯至三千余年前的古代文明,古埃及与印度的先民们便智慧地运用阳光激活草药中的补骨脂素成分,以治疗白癜风病症(https://doi.org/10.1021/cr900300p)。这一古老实践预示着光疗潜力的萌芽。至19世纪末,科学界迎来了光疗发展历程中的一次重要转折。1900年,奥斯卡-拉布(Oscar Raab)偶然间发现,在特定染料与光线的共同作用下,寄生虫能被有效杀灭,而这一效应在无光环境中则不复存在,这一发现催生了“光动力作用”这一科学术语的诞生(https://doi.org/10.3390/jcm8101581)。
1903年,Von Tappeiner与Jesionek的开创性工作更是将光动力疗法(PDT)推向了临床应用的前沿,他们首次利用局部曙红结合白光成功治疗了皮肤肿瘤(https://doi.org/10.3390/cancers9020019),标志着PDT时代的正式开启。
时间流转至20世纪70年代,医学界迎来了PDT发展的又一里程碑。梅奥诊所的R. L. Lipson与S. Schwartz引入了第一代光敏剂——血卟啉衍生物(HpD),将其应用于癌症治疗,这一创新不仅极大地推动了PDT领域的发展,更为癌症治疗开辟了新的路径(https://doi.org/10.1038/bjc.1975.30)。随后,在1993年,加拿大率先批准了纯化后的血卟啉衍生物Photofrin用于治疗膀胱癌,进一步巩固了PDT在癌症治疗中的地位(https://doi.org/10.1089/clm.1996.14.219)。
然而,随着研究的深入,第一代PSs因其复杂的化学成分、高频率的皮肤过敏反应及有限的光穿透深度等局限性,逐渐难以满足临床需求。在此背景下,第二代PSs应运而生,它们包括卟啉、卟吩、金属酞菁及融合环醌衍生物等,展现出更高的吸光度(集中在650-800纳米范围)及更为优越的治疗特性。尽管如此,第二代PSs仍面临着生物相容性差、特异性不足、严重皮肤过敏反应及显著副作用等挑战,限制了其广泛应用。
为克服上述难题,当前研究正聚焦于开发具有更强靶向能力及更佳生物相容性的第三代光敏剂(PSs)或光热转换剂(PTAs),这些新型治疗剂在实验室研究与临床应用中均展现出巨大潜力,有望成为未来抗癌治疗的新希望。
肿瘤光疗的定义及机理
在光疗的广阔领域中,依据其独特的治疗机制,可明确划分为光动力疗法(PDT)与光热疗法(PTT)两大类别,如图1所示(https://doi.org/10.1002/adhm.201701211)。PDT作为一种非侵入性的癌症治疗手段,其核心在于光、光敏剂(PS)与氧这三者的协同作用。具体而言,PS在吸收特定波长的光能后,可经由I型或II型PDT路径,触发电子转移或能量传递过程,进而生成细胞毒性活性氧(ROS),这些ROS对肿瘤细胞构成致命威胁,诱导其凋亡或坏死。
另一方面,PTT则是一种利用光热效应诱导细胞凋亡的创新策略,其核心机制在于通过光吸收激发电子,随后发生非辐射性衰变,释放出的动能转化为热能,从而提升组织温度至高温状态(hyperthermia)。鉴于肿瘤组织内血管结构的异质性,相较于正常组织,肿瘤组织对高温表现出更高的敏感性。当生物组织周围环境温度攀升至43°C以上时,这一高温环境将对细胞内的蛋白质结构及DNA功能造成难以逆转的损害,进而触发细胞凋亡与坏死过程,实现治疗目的。 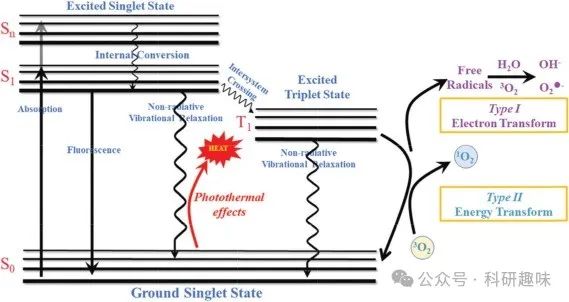 图 1.用于光疗的雅布隆斯基示意图(https://doi.org/10.1039/d1tb00349f)
图 1.用于光疗的雅布隆斯基示意图(https://doi.org/10.1039/d1tb00349f)
光诊疗试剂的分类
在光治疗领域,一系列基于分子的光敏剂,诸如porfimer、氨基乙酰丙酸及temoporfin等,凭借其卓越的单线态氧产量与强大的抗肿瘤活性,已成功步入临床应用阶段,并取得了显著的治疗效果。然而,这些分子光疗药物面临的疏水性挑战、潜在的皮肤光毒性风险以及有限的靶向性能力,促使科研界积极探索创新策略。通过将光敏剂分子进行封装与纳米组装,形成纳米颗粒(NPs),不仅显著增强了药物的生物相容性,还实现了更为精准的靶向递送,为肿瘤光疗的深入发展铺平了道路。
近年来,随着纳米技术的飞速发展,一系列先进的纳米材料应运而生,它们在肿瘤光疗中展现出巨大潜力。这些纳米材料涵盖了无机与有机单一光疗NPs(如表1所示)、融合了多种治疗机制的组合光疗NPs、以及采用智能策略设计的肿瘤光疗纳米药物。此外,还有部分纳米制剂已成功进入临床试验阶段(如图2所示),这些成果共同验证了纳米材料在提升肿瘤治疗效率方面的显著优势。通过精准调控纳米材料的尺寸、形状、表面性质及功能化修饰,研究者们能够进一步优化药物的体内分布、增强肿瘤组织穿透力、减少副作用,并实现对肿瘤细胞的精准打击,从而为癌症患者带来更加安全、有效的治疗选择。
Table 1. Phototherapeutic agents and their therapeutic activities.
| Phototherapeutic agent | Mechanism | Advantages | Disadvantages |
|---|---|---|---|
| Au | PTT | Efficient PCE, great biocompatibility and penetrate deep tissues | Instability and retention possibility in vivo |
| Ag | PDT/PTT | Anti-bacterial properties and oxidatively stressing tumors | Oxidation and poor biocompatibility |
| Cu | PDT/PTT | Widely tunable absorption in the NIR region | Unpredictable pharmacokinetics, undesired biocompatibility, and detention toxicity |
| Fe | PTT | Distinctive magnetism | Lack of study on long-term effects on the living body |
| W | PTT | Strong NIR absorption and high PCE | The possibility of long-term toxicity |
| Mo | PDT/PTT | Great biocompatibility, high PCE, and excellent NIR absorption | Lack of study in potential toxicity and biological safety along with drug metabolism |
| C | PDT/PTT | Stably generating local hyperthermia and using it as drug delivery platforms | Causing peroxidation damage for normal cells and inducing acute inflammation |
| BP | PDT/PTT | High production efficiency of 1O2 and great NIR absorption | Lack of biodegradation mechanism and long-term biosafety |
| UC | PDT | Minimized photodamage, weak photobleaching, and great photostability | Potential side effects of emitted UV light |
| MXenes | PTT | High biocompatibility, strong NIR absorption, and excellent PCE | Lacking of cellular uptake pathway |
| Porphyrins | PDT/PTT | High 1O2 production efficiency, photothermal property, and outstanding fluorescence performance | Low water-solubility and easy self-aggregation |
| Phthalocyanines | PDT | Thermal stabilities and high extinction coefficients | Easy aggregation in aqueous solution and slow clearance from the body |
| BODIPY | PDT/PTT | Desired 1O2 generation, biocompatibility, and photostability | Low cellular uptake efficiencies |
| DPP | PDT/PTT | Tunable photophysical property, excellent photostability, and low dark toxicity | Damage to normal tissue and longer post-treatment darkroom processing times |
| Squaraine | PDT/PTT | Significant fluorescence, strong NIR absorption, and distinguish stability | Susceptible to being attacked by nucleophilic effects |
| Cyanine | PDT/PTT | High molar absorptivity, narrow absorption/emission band, and reasonable fluorescence quantum yield | Instability in light |
| SP | PDT/PTT | Excellent photostability, and good biocompatibility | Unclear the impact of SP NPs on the fate and function of certain cell types |
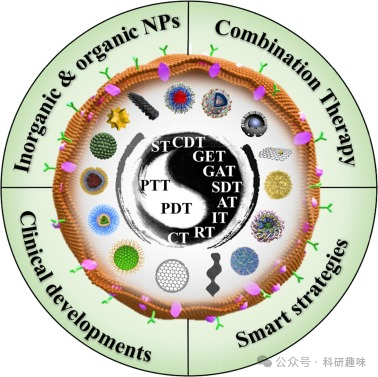 图 2.不同类型的光疗 NPs。我们指出了最常报道的纳米粒子的结构。插入:PTT:光热疗法;PDT:光动力疗法;CT:化疗;RT:放疗;IT:免疫疗法;AT:抗血管生成疗法;SDT:声动力疗法;GAT:气体疗法;GET:基因疗法;CDT:化学动力疗法;ST:饥饿疗法。
图 2.不同类型的光疗 NPs。我们指出了最常报道的纳米粒子的结构。插入:PTT:光热疗法;PDT:光动力疗法;CT:化疗;RT:放疗;IT:免疫疗法;AT:抗血管生成疗法;SDT:声动力疗法;GAT:气体疗法;GET:基因疗法;CDT:化学动力疗法;ST:饥饿疗法。
近红外光疗纳米材料——无机金属纳米粒子
金纳米粒子(Au NPs)
金纳米粒子(Au NPs),凭借其卓越的生物相容性、高效的光热转换效率(PCE)以及在近红外区域的强烈吸收能力,能够深入穿透组织,已成为光热疗法(PTT)中极具吸引力的光疗剂,并构建起一个高效的治疗平台。这些纳米粒子可通过精细调控,形成多样化的形态,如纳米棒、纳米壳、纳米笼及纳米球等(图3A),其治疗效率则高度依赖于其尺寸、形状及精细结构的优化。
自2003年起,Hirsch及其团队便前瞻性地利用了金属纳米壳的独特光学共振可调性,率先探索了金纳米粒子在PTT中的应用潜力。他们成功制备了PEG修饰的金/二氧化硅纳米壳,该材料在极短时间内(4-6分钟)即可实现显著的温度提升(ΔT = 37.4 ± 6.6°C),从而在体内引发不可逆的肿瘤损伤(https://doi.org/10.1073/pnas.2232479100)。此外,Singh等人的研究进一步揭示了金氧化物浓度与温升之间的正相关关系,即温升效应呈现出明显的染料浓度依赖性(图3B)(https://doi.org/10.1166/jbn.2016.2196)。
近年来,鉴于金纳米粒子介导的PTT所展现出的卓越治疗效果,该领域的研究得到了广泛而深入的拓展。特别是,金氧化物与光敏剂(PSs)的共轭策略,为实现多模式癌症治疗提供了可能。Wang等人便报道了一种创新的多功能Au NPs(PTX-PP@Au NPs),该纳米平台巧妙融合了PTT、PDT及化疗三种治疗手段,展现出优异的药物释放特性。通过阻断细胞周期及TRPV6阳离子通道,该纳米体系有效抑制了前列腺癌的生长,并同步产生了理想的热效应与丰富的活性氧(ROS),且在治疗过程中未观察到显著副作用(图3C和D)(https://doi.org/10.1016/j.biomaterials.2019.05.009)。这一研究成果不仅为癌症治疗开辟了新途径,也彰显了金纳米粒子在精准医疗领域的巨大潜力。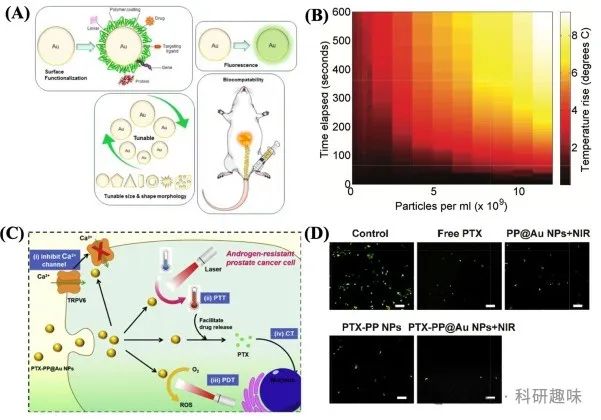 图 3:(A)金纳米颗粒的重要特性(https://doi.org/10.3390/ijms19071979)。(B) 不同浓度的金纳米棒随时间的温度升高,颜色表示温度升高的摄氏度(https://doi.org/10.1166/jbn.2016.2196)。(C)协同处理 ARPC 细胞的概况。(D)前列腺肿瘤细胞中钙钛矿-AM的荧光图像。PTX-PP@Au NPs + NIR 组活细胞较少(绿色)(标尺 = 50 μm)(https://doi.org/10.1016/j.biomaterials.2019.05.009)
图 3:(A)金纳米颗粒的重要特性(https://doi.org/10.3390/ijms19071979)。(B) 不同浓度的金纳米棒随时间的温度升高,颜色表示温度升高的摄氏度(https://doi.org/10.1166/jbn.2016.2196)。(C)协同处理 ARPC 细胞的概况。(D)前列腺肿瘤细胞中钙钛矿-AM的荧光图像。PTX-PP@Au NPs + NIR 组活细胞较少(绿色)(标尺 = 50 μm)(https://doi.org/10.1016/j.biomaterials.2019.05.009)
金氧化物因其独特的理化性质,在临床试验中亦展现出重要应用潜力。具体而言,Aurolase® 在800纳米波长下展现出高摩尔吸收率,成为光热疗法(PTT)领域备受瞩目的候选材料(https://doi.org/10.1039/d0bm00222d)。截至目前,已有两项针对Aurolase®的临床试验完成招募与实施,其研究目的分别聚焦于评估该材料在治疗原发性或转移性肺肿瘤(临床试验注册编号:NCT01679470,于ClinicalTrials.gov可查)以及难治性或复发性头颈部肿瘤中的抗肿瘤疗效(临床试验注册编号:NCT00848042,同样可于ClinicalTrials.gov检索)。值得注意的是,这两项临床试验均已在2014年前顺利完成,然而,其详细研究结果尚未正式公布。
综上所述,金氧化物作为一类极具前景的光治疗剂,其在癌症光疗领域的临床应用潜力不可忽视。然而,同时也需审慎考量其稳定性问题以及在体内可能存在的长期滞留风险,这些因素对于其临床转化与安全应用至关重要。未来研究应致力于进一步优化金氧化物的物理化学性质,提升其稳定性与生物相容性,以推动其在癌症治疗领域的广泛应用。
银纳米粒子(Ag NPs)
银纳米粒子(Ag NPs),作为一类成本效益显著的贵金属纳米材料,凭借其简便的合成工艺、卓越的物理与电学性能、显著的抗菌活性以及独特的光疗潜力,在生物医学领域引起了广泛关注。尤为突出的是,Ag NPs能够诱导肿瘤细胞内产生强烈的氧化应激反应,进而触发细胞凋亡机制,展现出针对肿瘤治疗的直接效果。
Cui及其研究团队创新性地开发了白蛋白稳定的银纳米点,这些纳米点在治疗后能够迅速提升肿瘤表面温度至高达20°C的增幅,通过热效应直接诱导肿瘤细胞死亡,且在治疗过程中未观察到显著的副作用,为肿瘤热疗提供了一种高效且安全的新策略(https://doi.org/10.1021/acsami.6b16133)。
此外,Ag NPs还展现出在光动力疗法(PDT)与光热疗法(PTT)协同治疗中的巨大潜力。Yang等人巧妙利用疏水作用原理,成功合成了Pt1Ag28纳米复合材料,并通过荧光成像(FI)技术实现了对肿瘤组织的精准定位与可视化。同时,该复合材料展现出的双模式靶向效应显著增强了PDT与PTT的联合治疗效果,为肿瘤的多模式治疗开辟了新途径(图4A)(https://doi.org/10.1016/j.colsurfb.2020.111346)。
尽管Ag NPs在成本上相较于金纳米粒子(Au NPs)具有明显优势,但其在实际应用中仍面临易氧化、生物相容性欠佳等挑战,这些因素在一定程度上限制了其在癌症光疗领域的广泛应用。因此,未来研究需进一步聚焦于提升Ag NPs的稳定性与生物安全性,以充分发挥其在肿瘤治疗中的独特优势。 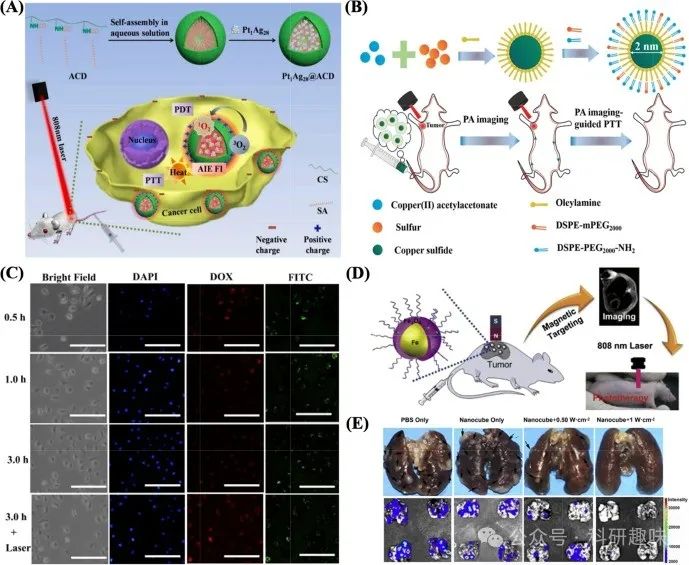 图 4:(A)Pt1Ag28@ACD 平台用于自组装、增强靶向递送和聚集诱导的 FI 辅助 PDT/PTT 协同效应(https://doi.org/10.1016/j.colsurfb.2020.111346)。(B) u-Cu2-xS NDs 的合成过程,该 NDs 被设计为由单一成分组成的 PA 成像引导的 PTT 治疗纳米平台(https://doi.org/10.1002/smll.201403249)。(C) 光控 DOX 在 HepG2 细胞中释放的荧光图像。比例尺 = 50 μm (https://doi.org/10.1016/j.msec.2018.11.020)。(D) 磁靶向 MRI 和近红外光热疗法 (https://doi.org/10.1016/j.biomaterials.2014.04.063)。(E)用 PBS、(NH4)xWO3 纳米管和(NH4)xWO3 纳米管治疗的小鼠在 1064 纳米激光照射后的代表性肺部图像。以及通过 BLI 检查确定的 4 个 T1-Luc 乳腺肿瘤的肺转移情况(https://doi.org/10.1016/j.biomaterials.2015.02.054)。
图 4:(A)Pt1Ag28@ACD 平台用于自组装、增强靶向递送和聚集诱导的 FI 辅助 PDT/PTT 协同效应(https://doi.org/10.1016/j.colsurfb.2020.111346)。(B) u-Cu2-xS NDs 的合成过程,该 NDs 被设计为由单一成分组成的 PA 成像引导的 PTT 治疗纳米平台(https://doi.org/10.1002/smll.201403249)。(C) 光控 DOX 在 HepG2 细胞中释放的荧光图像。比例尺 = 50 μm (https://doi.org/10.1016/j.msec.2018.11.020)。(D) 磁靶向 MRI 和近红外光热疗法 (https://doi.org/10.1016/j.biomaterials.2014.04.063)。(E)用 PBS、(NH4)xWO3 纳米管和(NH4)xWO3 纳米管治疗的小鼠在 1064 纳米激光照射后的代表性肺部图像。以及通过 BLI 检查确定的 4 个 T1-Luc 乳腺肿瘤的肺转移情况(https://doi.org/10.1016/j.biomaterials.2015.02.054)。
铜纳米粒子(Cu NPs)
硒化铜、碲化铜、氧化铜及硫化铜等多样化的铜基纳米粒子(Cu NPs)展现出强烈的近红外(NIR)吸收特性,这一现象归因于空位掺杂半导体NPs中p型载流子所诱导的局部表面等离子体共振效应。在众多纳米材料中,硫化铜(CuS)因其在NIR区域(700-1100纳米)内可调谐的吸收特性而备受瞩目。该区域的光子几乎不被生物组织所吸收,从而有效降低了背景噪声干扰,显著提升了光声成像(PAI)的空间分辨率,并最大限度地减少了对正常组织的非特异性损伤。
Mou及其团队研发了一种超小型(直径小于5纳米)的近红外响应Cu2-xS纳米粒子(u-Cu2-xS NPs),这些纳米粒子展现了卓越的光热转换能力,在激光照射下能够诱导HeLa细胞发生显著的消融与凋亡过程(图4B所示)(https://doi.org/10.1002/smll.201403249)。此外,Cu NPs还展现出固有的光动力学活性,为癌症的光动力疗法(PDT)与光热疗法(PTT)联合治疗提供了可能。
Li等人则通过精巧的合成策略,制备了具有局部表面等离子体共振帽的空心CuS NPs。这种特殊结构不仅增强了纳米粒子在NIR区域的吸收效率与光热转换效率(PCE),还揭示了释放的Cu+离子与活性氧(ROS)生成之间的关键联系。在NIR光照射下,CuS NPs能够通过内吞或巨胞饮作用被HepG2细胞迅速摄取,这一过程可通过FITC荧光标记(呈现绿色荧光)直观地验证(图4C所示)(https://doi.org/10.1016/j.msec.2018.11.020)。
尽管Cu NPs在癌症光疗领域展现出巨大的应用潜力,但在迈向临床应用的道路上仍面临诸多挑战,包括其药代动力学的不可预测性、生物相容性的进一步提升需求,以及Cu基NPs在体内滞留可能引发的毒性问题等。因此,未来的研究需聚焦于解决这些关键障碍,以确保Cu NPs在癌症治疗中的安全、有效应用。
铁纳米粒子(Fe NPs)
铁纳米粒子(Fe NPs),凭借其卓越的生物相容性、独特的磁性特征、理想的生物降解性以及低毒性,在生物医学领域占据了举足轻重的地位。尤为引人注目的是,其表面性质的特异性使得Fe NPs能够精准靶向癌细胞并深入肿瘤组织内部,这一特性进一步拓宽了其在临床应用的潜力。值得注意的是,美国食品和药物管理局(FDA)已正式批准部分铁纳米粒子作为造影剂应用于临床实践中,这标志着其在医疗领域的认可与接受。
近年来,针对Fe NPs在近红外辐射下产生的高热效应进行了广泛而深入的研究。Zhou等人成功制备了PEG化的Fe@Fe3O4 NPs,这些纳米粒子在808纳米激光照射仅10分钟后,便展现出对HeLa细胞的特异性靶向与高效消融能力(图4D所示)。此外,PEG化的Fe@Fe3O4 NPs还兼具磁共振成像功能,加之其易获取性、高稳定性及低毒性,为其未来的临床应用奠定了坚实基础(https://doi.org/10.1016/j.biomaterials.2014.04.063)。
为进一步提升Fe NPs的靶向效能,Yang等人创新性地开发了透明质酸修饰的超顺磁性氧化铁NPs(HA-SPIONs),这些纳米粒子能够特异性地识别并结合CD44(透明质酸受体)过表达的乳腺癌细胞。体内外实验均证实,HA-SPIONs不仅显著增强了药物在肿瘤部位的积累,还在近红外光照射下迅速诱导了光热消融效应,展现了良好的治疗效果(https://doi.org/10.2147/IJN.S121249)。
尤为重要的是,Fe NPs在临床应用中展现出了一项独特优势——磁性靶向递送能力。这一特性使其能够克服传统PDT/PTT疗法中高激光功率可能对周围健康组织造成的不利影响。例如,由FeO NPs构成的NanoTherm®疗法,在外部磁场的激活下可产生热量(即磁热疗法),该疗法已获欧洲药品管理局(EMA)批准用于治疗脑肿瘤,并在美国进行积极的临床研究(https://doi.org/10.2217/nnm-2017-0336)。
尽管纳米技术的迅猛发展极大地推动了Fe NPs在肿瘤治疗中的应用前景,但当前仍面临智能设计、简易制造及可重复大规模生产等挑战,这些限制了其临床应用的广泛推广。此外,对于Fe NPs在生物体内的长期效应及安全性评估也亟待深入研究与明确。
其他金属纳米粒子
钨(W)纳米粒子,凭借其外层d价电子的独特构型,展现出显著的局域表面等离子体共振效应,这一特性赋予了它们强大的近红外吸收能力和较高的光热转换效率(PCE)。Guo及其研究团队通过创新的高温溶热法成功制备了(NH4)xWO3纳米粒子(NPs),这些NPs能够迅速提升肿瘤区域的温度,实现高效的肿瘤消融效果。尤为值得关注的是,在乳腺癌肺转移模型的实验中,(NH4)xWO3 NPs展现出了令人鼓舞的抑制肿瘤转移效率,达到了预期目标(如图4E所示)(https://doi.org/10.1016/j.biomaterials.2015.02.054)。然而,不容忽视的是,W基NPs的粒径普遍超过100纳米,这一尺寸特性可能引发长期毒性的风险。因此,未来研究应聚焦于结构优化,旨在提升治疗效果的同时,探索更为安全的生物排泄路径。
作为过渡金属半导体纳米结构的杰出代表,钼基纳米粒子(Mo NPs)凭借其卓越的生物相容性、高PCE以及优异的近红外吸收特性,在光疗领域掀起了一股研究热潮。Yin等人通过简便高效的水热法,成功合成了PEG修饰的MoOx纳米粒子(PEG-MoOx NPs)。这种生物相容性优异的PEG-MoOx NPs不仅兼具光热疗法(PTT)与光动力疗法(PDT)的协同治疗效果,还能被细胞高效摄取。在1064纳米激光的照射下,PEG-MoOx NPs能够显著抑制体内癌细胞的生长(如图5A所示)(https://doi.org/10.1039/c7nr07927c)。尽管Mo NPs在癌症治疗领域展现出巨大的潜力,但其临床应用的道路仍充满挑战。未来需进行更为系统深入的研究,全面评估Mo NPs的潜在毒性、生物安全性以及药物代谢特性,为其早日走向临床奠定坚实基础。 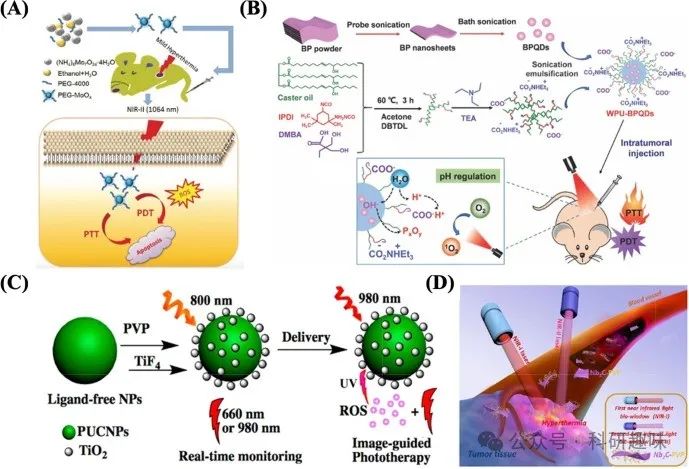 图 5:(A)PEG-MoOx NPs 的合成及 NIR-II 1064 nm 激光诱导的协同 PTT 和温和热疗条件下的肿瘤 PDT 的示意图。(B) WPU-BPQD 治疗示意图。(C)使用 PUCNPs@TiO2 进行实时监测和图像引导光疗的光开关 PDT 方案。(D)二维生物可降解 Nb2C(用 PVP 修饰)在近红外-I 和近红外-II 生物窗口中用于体内光热消融肿瘤的示意图。
图 5:(A)PEG-MoOx NPs 的合成及 NIR-II 1064 nm 激光诱导的协同 PTT 和温和热疗条件下的肿瘤 PDT 的示意图。(B) WPU-BPQD 治疗示意图。(C)使用 PUCNPs@TiO2 进行实时监测和图像引导光疗的光开关 PDT 方案。(D)二维生物可降解 Nb2C(用 PVP 修饰)在近红外-I 和近红外-II 生物窗口中用于体内光热消融肿瘤的示意图。
近红外光疗纳米材料——无机非金属纳米粒子
碳纳米粒子(C NPs)
碳基纳米粒子(C NPs),作为光热疗法(PTT)中最早应用的光热剂(PTAs)之一,其独特的电学、热学以及显著的近红外吸收特性使其成为该领域的研究热点。这一大类材料,涵盖碳纳米管、氧化石墨烯、石墨烯量子点、碳点及其复合材料,能够在近红外光照射下持续且稳定地产生局部热效应,有效实现癌细胞的消除。
进一步地,C NPs因其固有的疏水性,被开发为高效的药物递送平台,能够负载并稳定携带药物分子,实现PTT与药物治疗的协同增效。Marangon等人创新性地制备了装载m-四羟基苯基氯(mTHPC)的C纳米管,应用于抗卵巢癌的PTT/光动力疗法(PDT)联合治疗。他们发现,mTHPC与C纳米管的结合不仅增强了光稳定性,还促进了癌细胞对药物的摄取,同时减少了药物的非特异性分布(https://doi.org/10.1016/j.carbon.2015.08.023)。
在提升PTT效果方面,Yang等人通过精细调控非共价PEG包覆的超小还原氧化石墨烯(nRGO-PEG)的尺寸与表面覆盖率,在动物实验中实现了更高的体内治疗效率。这一研究强调了材料设计与优化在提升光疗效果中的关键作用(https://doi.org/10.1016/j.biomaterials.2011.11.064)。
然而,尽管C NPs在光疗领域展现出巨大潜力,其临床应用仍面临诸多挑战。首要问题是药物在器官中的累积以及长期潜在的细胞毒性,这要求我们在材料设计与使用策略上不断探索与创新。此外,C NPs的晶格缺陷可能诱导正常细胞发生过氧化损伤,而由其引发的炎症反应更是可能触发成纤维细胞系的急性炎症及DNA损伤,这些安全性问题在推动C NPs临床转化前必须得到妥善解决。 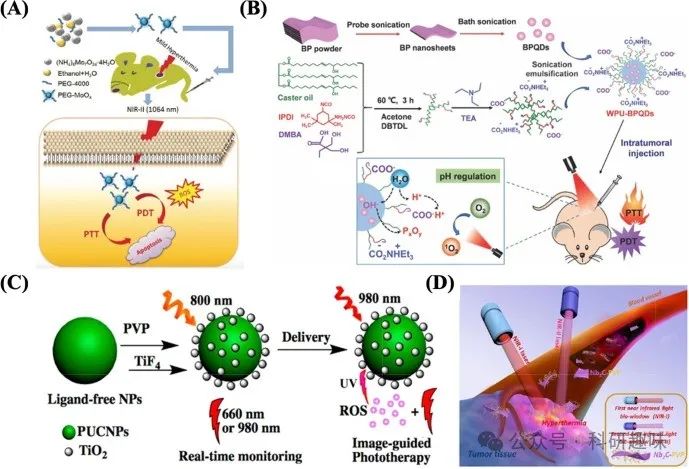 图 5:(A)PEG-MoOx NPs 的合成及 NIR-II 1064 nm 激光诱导的协同 PTT 和温和热疗条件下的肿瘤 PDT 的示意图。(B) WPU-BPQD 治疗示意图。(C)使用 PUCNPs@TiO2 进行实时监测和图像引导光疗的光开关 PDT 方案。(D)二维生物可降解 Nb2C(用 PVP 修饰)在近红外-I 和近红外-II 生物窗口中用于体内光热消融肿瘤的示意图。
图 5:(A)PEG-MoOx NPs 的合成及 NIR-II 1064 nm 激光诱导的协同 PTT 和温和热疗条件下的肿瘤 PDT 的示意图。(B) WPU-BPQD 治疗示意图。(C)使用 PUCNPs@TiO2 进行实时监测和图像引导光疗的光开关 PDT 方案。(D)二维生物可降解 Nb2C(用 PVP 修饰)在近红外-I 和近红外-II 生物窗口中用于体内光热消融肿瘤的示意图。
黑磷纳米粒子(BP NPs)
黑磷(BP),作为磷的一种独特同素异形体,其结构由层层堆叠、易于剥离至超薄纳米尺度的皱褶磷层构成。BP纳米粒子(BP NPs)凭借其卓越的单线态氧(^1O2)生成效率与强大的近红外光吸收能力,在光动力疗法(PDT)与光热疗法(PTT)领域展现出非凡的应用前景。Guo等人的研究聚焦于BP量子点(BPQD)的合成,深入探索了其优异的光敏性能与生物相容性。实验结果显示,BPQD不仅具备高效的1O2生成能力,即便在最高浓度下对HeLa或LO2细胞也几乎不产生暗毒性,进一步验证了在BPQD与光照联合作用下,高达86.8%的癌细胞被有效杀灭,彰显了BP在癌症光疗领域的巨大潜力(https://doi.org/10.1002/smll.201702815)。
为克服BPQD在环境稳定性及水分散性方面的局限,Lu等人创新性地设计了包覆有阴离子水性聚氨酯纳米粒子(WPU NPs)的BPQD(WPU-BPQDs)。这一策略不仅显著提升了BPQD产生活性氧(ROS)的效率,而且WPU NPs独特的电化学双层结构还能有效调节BPQD降解过程中产生的酸性环境,该环境通常对ROS的生成具有抑制作用。通过这一调控机制,ROS的生成得到增强,进而提升了活体光导疗法的治疗效果(如图5B所示)(https://doi.org/10.1039/d0tb02101f)。
尽管BP NPs在生物医学应用中展现出良好的生物相容性与光稳定性,但其进一步的研究与发展仍面临诸多挑战。首要难题在于如何实现BP NPs的大规模、均一化生产;其次,如何通过精细的功能化修饰策略提升其在肿瘤组织中的靶向效率;最后,对BP NPs的生物降解机制及长期生物安全性的深入研究也是不可或缺的,这些问题的解决将是推动BP NPs在临床医学中广泛应用的关键所在。
上转化纳米粒子 (UCNPs)
上转换纳米粒子(UCNPs),作为一类将长波长近红外光高效转换为可见光或短波紫外光的纳米材料,其独特的发光机制基于镧系金属、过渡金属或掺锕系元素离子在无机晶体基质中的稳定嵌入。这一特性赋予了UCNPs在光疗领域显著的优势,包括低光损伤、深组织穿透能力、弱光漂白效应以及卓越的光稳定性。自2007年Zhang等人开创性地将NaYF4:Yb3+/Er3+ UCNPs应用于光动力疗法以来,该领域便迎来了新的突破。这些UCNPs在974纳米低能量红外光激发下,能够发射出537和635纳米附近的高能可见光,进一步通过多孔二氧化硅壳层中嵌入的美洛青540(一种光敏剂),实现了ROS的有效生成与MCF-7/AZ乳腺癌细胞的毒性消融,展现了光疗与纳米技术的完美结合(https://doi.org/10.1021/ja0700707)。
UCNPs不仅提升了光治疗剂的光能利用效率,还激发了科研人员对多功能UCNPs的探索热情,特别是在图像引导光疗与多模式疗法方面。Zuo等人设计的TiO2包覆的NaErF4@NaYF4@NaYbF4:0.5%Tm@NaYF4 UCNPs,通过实现紫外-蓝色区域的全光切换,并结合发射光谱的体内监测,成功应用于图像引导下的光导治疗,为精准医疗提供了有力工具(图5C)(https://doi.org/10.1021/acsnano.7b07393)。
尽管UCNPs在光疗领域展现出非凡的光学性能与稳定性,但其较低的转换量子产率(普遍<3%)及有限的生物相容性仍是制约其临床转化的瓶颈。此外,尽管近红外光对生物组织相对安全,但980纳米波长的热效应仍是体内应用时需谨慎考虑的因素。因此,探索更低热效应的激发波长(如915或808纳米)成为研究热点,旨在减少组织损伤。同时,对于UCNPs发射的紫外线可能带来的光致癌等潜在风险,也需在临床应用前进行全面而深入的评估。
组合纳米材料(MXenes)
MXenes,作为一类由过渡金属(主要集中在元素周期表的第3和第4族)与碳(C)、氮化物(N)或碳氮化合物组成的二维材料,其化学通式可简化为Mn+1Xn(n = 1-3),其中M代表如钛(Ti)、锆(Zr)、铬(Cr)、钒(V)、铪(Hf)、铌(Nb)、钪(Sc)、钽(Ta)、钼(Mo)等早期过渡金属,X则为C或N。这类材料以其卓越的生物相容性、强烈的近红外光吸收能力以及出色的光电转换效率(PCE),在光疗领域引起了广泛的研究兴趣。
尤为值得注意的是,MXenes表面密布着羟基、氧和氟等官能团,赋予其优异的亲水性和表面可修饰性,为实现自适应的表面功能化提供了可能。Szuplewska等人开创性地探索了Ti2C纳米颗粒(NPs)作为新型、高效且选择性的光热治疗(PTT)试剂的潜力,其在体外实验中展现了显著的近红外光诱导癌细胞消融能力,预示着其作为未来癌症光治疗剂的巨大潜力(https://doi.org/10.1016/j.msec.2019.01.021)。
近红外光谱区域可细分为近红外-I区(650-950纳米)和近红外-II区(1000-1500纳米)。引人注目的是,基于MXene的材料在这两个波段均表现出强大的光吸收能力和高PCE,这显著提升了光能的利用效率并增强了激光在组织中的穿透深度。例如,Lin等人制备的新型碳化铌(Nb2C)MXene,在NIR-I和NIR-II波段均成功实现了对小鼠肿瘤异种移植物的光热破坏。该Nb2C NPs不仅展现出极高的PCE(在NIR-I区为36.4%,在NIR-II区为45.65%),还具备优异的光热稳定性。因此,经Nb2C NPs治疗的小鼠肿瘤在16天内完全消退,且在随后的50天内未出现复发(图5D)(https://doi.org/10.1021/jacs.7b07818)。
尽管MXenes在癌症光疗领域展现出巨大的应用前景,但其临床转化之路仍布满挑战,如MXene NPs的细胞摄取机制尚需深入探究,以及表面修饰对其生物相容性的影响需进一步评估。这些问题的解决将是推动MXenes在光疗领域迈向临床应用的关键所在。
近红外光疗纳米材料——有机纳米粒子
有机光治疗剂包括近红外响应小分子和有机半导体聚合物纳米粒子(NPs)。具有代表性的分子光治疗剂的化学核心结构如图 6 所示。 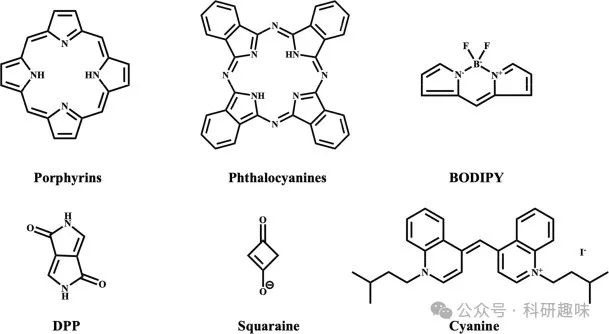 图 6.具有代表性的分子光治疗剂的化学核心结构。
图 6.具有代表性的分子光治疗剂的化学核心结构。
卟啉 NPs
卟啉,作为一种典型的18π电子芳香族大环化合物,其独特的可见光区特征吸收光谱,加之其高效的单线态氧(1O2)生成能力、优异的光热转换特性及荧光性能,在光疗领域展现出非凡的潜力与独特优势。然而,卟啉固有的低水溶性及易于自聚集的缺点,极大地限制了其在癌症光疗中的药物吸收效率与亚细胞定位精度。为解决这一问题,科研人员通过两亲性卟啉分子的自组装策略,成功制备了卟啉纳米粒子(NPs),有效改善了其亲水性能,并显著提升了生物利用度。例如,Pucelik团队合成的两亲性氟化卟啉,不仅实现了精准的细胞内定位,还展现出增强的光毒性及高产量的1O2生成,为癌症光疗提供了新的策略(https://doi.org/10.3390/ijms21082786)。此外,Jin等人开发的叶酸共轭卟啉,通过增强药物的选择性,使得纳米药物在癌细胞中的内化效率较非靶向药物提升了惊人的58.7倍,实现了体内肿瘤的完全消融(https://doi.org/10.1002/adhm.201300651)。
金属有机框架(MOFs),作为一类由金属离子/离子簇与有机配体通过配位键连接而成的多孔有机-无机杂化材料,因其高孔隙率、良好的可功能化特性,在药物/货物递送及癌症治疗领域展现出广阔的应用前景[74]。特别是基于卟啉基有机配体构建的智能MOFs,能够应用于局部光动力治疗(PD),显著提升抗肿瘤的靶向效率。Zhou等人利用Zr6金属簇与四(4-羧基苯基)卟啉配体,结合叶酸(FA)修饰,合成了Zr(IV)基卟啉MOF(PCN-44)。其中,PCN-224表面的FA修饰显著增强了MOF的主动靶向性,从而提高了局部放疗的治疗效果(https://doi.org/10.1021/jacs.6b00007)。
尽管卟啉在光疗领域展现出诸多优势,但其肿瘤穿透力的局限性限制了其在深层或不可触及肿瘤治疗中的应用,主要集中于皮肤癌、膀胱癌等浅表性肿瘤。值得注意的是,卟啉钠(Photofrin®),作为首代获临床批准的光敏剂(PS),以其可忽略的长期副作用、良好的重现性及无耐药性特点,在延长无法手术肿瘤患者的生存期方面发挥了重要作用。然而,治疗过程中伴随的皮肤光敏反应及代谢紊乱问题仍需引起高度重视(https://doi.org/10.1080/14756366.2020.1755669)。
酞菁纳米粒子(Pc NPs)
酞菁纳米粒子(Pc NPs)凭借其卓越的热稳定性、高消光系数以及在近红外区域的强烈吸收特性,在光导治疗、半导体技术及非线性光学领域受到了广泛而深入的研究。当前,一种创新的ZnPc光敏剂正处于中国临床II期试验阶段,其推荐的有效剂量设定为0.20 mg/kg(对应于治疗时血浆浓度约1.578 μM),该光敏剂在光动力疗法(PDT)中对抗癌症已展现出显著的临床效果(https://doi.org/10.1007/s00280-020-04096-y)。Li等人通过合成一种具备近红外吸收能力的2-吡啶酮修饰锌酞菁(ZnPc-PYR),旨在提升光在生物组织中的穿透深度,并促进在缺氧肿瘤微环境(TME)中单线态氧(1O2)的释放。此外,该修饰还通过下调缺氧诱导因子-1(HIF-1)的表达,增强了癌细胞对PDT的敏感性,从而实现了治疗效果的显著提升(https://doi.org/10.1039/d1cc00645b)。
Abrahamse等人的研究表明,优化后的金属锌基酞菁(ZnPcSmix)能够有效消融结肠腺癌细胞(如DLD-1和Caco-2),并实现了在溶酶体和线粒体中的精确定位。尤为有趣的是,他们在溶酶体内观察到了由蛋白水解酶cathepsin D诱导的线粒体细胞色素C延迟释放及pH值下降的现象,这进一步揭示了ZnPcSmix介导的PDT诱导细胞凋亡可能与酸性溶酶体的激活密切相关(https://doi.org/10.3390/ijms20133254)。
在2020年,Vendette等人利用封装有氯氰铝酞菁的壳聚糖纳米胶囊对12例宫颈上皮内瘤变(CIN)患者进行了临床治疗尝试。结果显示,其中11例患者(91.7%)在首次评估时宫颈细胞学检查结果转为阴性,而仅有1例(8.3%)未见疗效。值得注意的是,在初次治疗反应良好的11名患者中,虽有两人病情复发,但经过第二轮PDT治疗后,其细胞学结果均得到缓解,并在后续随访中持续保持阴性状态,且所有参与患者均未报告严重副作用(https://doi.org/10.1080/02656736.2020.1804077)。需强调的是,此临床试验仅限于CIN1和CIN2患者,未纳入CIN3或浸润性宫颈癌病例。
另一方面,硅Pc4也已成功完成针对光化性角化病、鲍温氏病及皮肤癌的一期临床试验(Clinical Trials.gov 标识符:NCT00103246)。然而,在针对皮肤癌的初步研究中,尚缺乏全面的药代动力学评估及最大耐受剂量的确立(https://doi.org/10.3389/fonc.2011.00014)。
尽管Pcs展现出诸多优势,但其易在水溶液中聚集及体内清除速率缓慢的问题不容忽视,这些问题不仅降低了其内在荧光强度,还限制了其在PDT中产生活性氧(ROS)的能力,从而构成了Pcs在临床应用中的关键挑战。
BODIPY纳米粒子 (BODIPY NPs)
BODIPY纳米粒子(NPs)作为一类拥有卓越近红外吸收与发射性能的小分子纳米探针,在癌症光疗领域因其杰出的光稳定性、优异的生物相容性、高摩尔消光系数以及高效的单线态氧(^1O2)生成能力而备受瞩目[83]。Chen等研究团队通过巧妙地将PEG-叶酸与三苯基膦进行功能化修饰,成功制备了具备线粒体双重靶向特性的近红外光响应氮杂-BODIPY衍生物——MeOABBr(即FMAB NPs)。此类NPs在近红外光照射下,能够高效产生活性氧(ROS)并引发高热效应,直接破坏线粒体的能量代谢途径,诱导线粒体功能障碍,最终触发细胞凋亡机制(如图7A所示)[https://doi.org/10.1039/c8tb01347k]。
Zou等人则另辟蹊径,合成了三种智能型BODIPY化合物(BDPmPh、BDPbiPh、BDPtriPh),这些化合物通过引入不同数量的二乙基氨基苯基基团进行调控,展现出对肿瘤特异性信号的响应能力,实现了在肿瘤治疗中的可控穿透深度(如图7B所示)。尤为引人注目的是,BDPtriPh NPs在813纳米波长处展现出最长的近红外吸光度,并达到了60.5%的高光子转换效率(PCE),这一特性不仅意味着其光穿透能力极强,还预示着在光疗应用中能够实现卓越的治疗效果。通过胰蓝染色实验进一步验证了BDPtriPh NPs出色的生物相容性与光毒性特性。此外,这些NPs在酸性肿瘤微环境(TME)中的质子化过程还能进一步提升其PCEs,为癌症的光动力疗法(PDT)/光热疗法(PTT)提供了波长与pH值双重调控的新策略[https://doi.org/10.1039/c8sc02443j]。 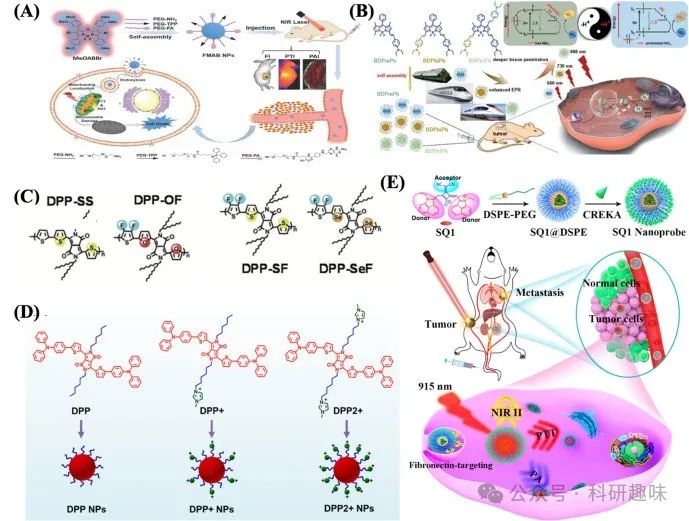 图 7:(A)用于多模态成像引导的 PDT/PTT 的 FMAB NPs。(B) BDPmPh、BDPbiPh 和 BDPtriPh NPs 的制备和应用示意图,以及 pH 触发 NPs 增强 PDT/PTT 的机理[85]。(C) DPP-SS、DPP-OF、DPP-SF 和 DPP-SeF 的化学结构 (D) DPP、DPP+ 和 DPP2 + NPs 的制备示意图 (E) 用于转移性乳腺癌 NIR-II/PA 双模成像和光热消融的水杨酸染料 SQ1 的分子工程和纳米功能化
图 7:(A)用于多模态成像引导的 PDT/PTT 的 FMAB NPs。(B) BDPmPh、BDPbiPh 和 BDPtriPh NPs 的制备和应用示意图,以及 pH 触发 NPs 增强 PDT/PTT 的机理[85]。(C) DPP-SS、DPP-OF、DPP-SF 和 DPP-SeF 的化学结构 (D) DPP、DPP+ 和 DPP2 + NPs 的制备示意图 (E) 用于转移性乳腺癌 NIR-II/PA 双模成像和光热消融的水杨酸染料 SQ1 的分子工程和纳米功能化
鉴于共价有机框架(COFs)所固有的优异有机特性、杰出的水稳定性、高度结晶性以及多孔结构,它们已逐渐崭露头角,成为一类极具潜力的纳米药物候选材料。Guan及其团队巧妙地将BODIPY分子与COF LZU-1相结合,通过精准的键合缺陷功能化策略,成功制备了LZU-1-BODIPY-2I纳米颗粒(NPs)。尽管BODIPY在NPs中的浓度相对较低,但LZU-1-BODIPY-2I NPs却展现出了对HeLa和MCF-7癌细胞系显著的消融能力。尤为重要的是,LZU-1对MCF-10A正常细胞表现出极低的细胞毒性,这一发现不仅凸显了COFs材料卓越的生物相容性,也为其在协同光疗抗癌领域的应用奠定了坚实的基础[https://doi.org/10.1016/j.isci.2019.03.028]。
尽管BODIPY相关领域的研究近年来取得了长足进展,但其在生物学层面的探索仍处于起步阶段。此外,当前BODIPY NPs的细胞摄取效率相较于多数商业化抗癌药物而言仍显不足。因此,为了进一步提升NPs的内吞能力,增强治疗效果,并推动其向临床应用的转化,亟需深入探索主动靶向技术。通过优化NPs的表面修饰、引入特异性识别基团等手段,有望实现BODIPY NPs在生物体内的精准定位与高效递送,从而为癌症治疗开辟新的途径。
DPP NPs
DPP(二苯并[b,d]噻吩并[3,2-b]噻吩)因其可调谐的光物理性质、高分子吸收系数、卓越的光稳定性及低暗毒性,在有机太阳能电池、荧光传感以及生物成像等前沿领域展现出广泛应用潜力[87]。DPP的独特供体-受体分子架构促进了HOMO(最高占有分子轨道)与LUMO(最低未占有分子轨道)的有效分离,同时缩小了S1(单重激发态)与T1(三重激发态)间的能隙,进而促进了单线态氧(^1O2)的高效生成,这对于光动力疗法(PDT)尤为重要。
Liu等科研团队深入探索了引入硫原子与氟原子的DPP衍生物(DPP-SeF),通过增强π-π堆叠与F⋯H相互作用,成功将光电转换效率(PCE)从32%提升至62%(如图7C所示),显著增强了光响应性能。在808纳米激光照射下,DPP-SeF对A549癌细胞的半数抑制浓度(IC50)由15.14 μg/mL降低至8.36 μg/mL,显示出增强的细胞毒性。尤为值得关注的是,DPP-SeF还展现出了优异的肿瘤组织光声成像能力和体内光热转换效应,为癌症的光声成像引导光热治疗(PTT)提供了新策略[https://doi.org/10.1039/d0bm01569e]。
为了实现更为精准的细胞器靶向,Li等人设计并合成了阳离子咪唑官能化的线粒体靶向DPP²⁺纳米颗粒(DPP2⁺ NPs)。该纳米系统显著提升了细胞对靶向线粒体的药物摄取效率,同时维持了较高的细胞膜电位,从而优化了PDT与PTT的协同治疗效果,并有效减少了非特异性毒性(如图7D所示)[https://doi.org/10.1021/acsami.0c06144]。
此外,Gao等研究团队聚焦于分子异构化对光电性能的影响,开发了结合顺/反-萜烯基苯酚的DPP NPs。特别是反式构型的萜烯基苯酚通过其醌共振效应增强了DPP的平面骨架稳定性,延长了有效共轭长度,在808纳米波长处实现了强吸收光谱。这一创新设计使得反式DPP NPs的PCE高达61.4%,相较于顺式DPP NPs(29.4%)提升了近210%,为提升DPP基光疗材料性能开辟了新的途径[https://doi.org/10.1021/acsami.0c16064]。
尽管DPP NPs在光疗领域取得了显著进展,但其临床应用仍面临挑战。首要问题是许多DPP NPs依赖增强渗透与滞留(EPR)效应被动富集于肿瘤组织,可能伴随正常组织的非特异性损伤。因此,在生物应用中需全面评估DPP衍生物的体内降解情况。此外,深入探索DPP衍生物的结构-性能关系,对于克服基于DPP的光疗局限性、推动其临床转化具有重要意义。
方酸 NPs
方酸染料,作为一类拥有缺电子中心四元环π-共轭结构的共振稳定齐聚物分子,凭借其独特的平面构型与齐聚物特性,在荧光发射、近红外吸收以及结构稳定性方面展现出卓越性能,近年来成为科学界关注的焦点。特别是在纳米制备过程中,方酸纳米粒子(NPs)通过J型聚集效应,能够显著地将吸收光谱红移至近红外区域,从而拓宽了其应用范围。Sun及其团队精心设计并合成了J型聚集的方酸NPs(SQP-NPs(J)),其近红外吸光度峰值达到901 nm,荧光发射峰则位于1036 nm,相较于H型聚集的SQP-NPs(H),其发射强度实现了4.8倍的提升。此外,SQP-NPs(J)的光电转换效率(PCE)高达36%,在药物内化和光照条件下,对肿瘤细胞的光消融效果更为显著[https://doi.org/10.1039/c8cc08096h]。
近期,Yao等研究人员通过引入丙二腈这一强吸电子基团,对方酸受体进行了强化改造,成功开发出一种适用于NIR-II区域的方酸染料(SQ1)。为了提升乳腺癌肺转移的治疗效率,他们进一步将SQ1 NPs表面修饰以活性靶向配体CREKA肽(图7E),实现了对肿瘤细胞的精准识别与结合。在NIR-II成像与光声成像的双重引导下,实现了对肿瘤细胞的全面光热消融,为癌症治疗开辟了新的路径[https://doi.org/10.1021/acsami.9b20147]。
尽管方酸染料在光疗领域展现出巨大潜力,但其发展仍面临诸多挑战。首要问题是方酸染料分子中的四元碳环结构易受亲核攻击,因此迫切需要进行结构优化以提高其稳定性。此外,增溶配体或封装策略虽能有效提升方酸染料的生物相容性,但同时也可能带来介质体积增加、削弱EPR效应(增强渗透与滞留效应)等不利影响。因此,在未来的研究中,需深入探索更加高效、安全的方酸染料改性方法,以推动其在生物医学领域的广泛应用。
Cyanine NPs
花菁染料,作为一类由π-共轭聚甲基链与多种氮杂环(诸如吡咯、咪唑、噻唑、苯并噻唑、吡啶或喹啉)构筑的化合物,其结构的多样性源于这些杂环的灵活组合。这类染料凭借其高摩尔吸收率、狭窄的吸收/发射光谱带、合理的荧光量子产率、可调谐的近红外荧光分布、良好的生物相容性以及低毒性,成为了成像引导治疗领域生物学研究的优选材料。市场上现有的花菁染料种类繁多,包括但不限于吲哚菁绿(ICG)、IR-125、IR-820、IR-830、Cy7.5、DiR、HITCI、IRDye800cw、IR-783、IR12-N3、Cy7、IR-775、IR-780、IR-806、IR-797、IR-140、CF770 和 Alex Fluo@750等。其中,ICG以其卓越的近红外吸收能力、鲜明的荧光特性及低暗毒性,在肝脏、心血管及前哨病变的诊断中展现出广阔前景。此外,ICG还被证实为一种有效的光热剂,能在近红外光照射下通过诱导氧化应激来抑制肿瘤生长。
然而,ICG亦存在光稳定性差、光漂白显著及对癌细胞特异性不足等缺陷。为克服这些局限,研究者们不断探索新型花菁染料。例如,Atchison等人开发了IR-783的碘化衍生物,旨在增强ISC过程并优化单线态氧(^1O2)的生成。与ICG相比,该衍生物在BxPC-3和MIA PaCa-2胰腺癌细胞系及小鼠模型中的光动力治疗(PDT)效果显著提升,预示着IR-783介导的PDT有望成为治疗高度侵袭性肿瘤的一种有前景的姑息性策略[https://doi.org/10.1039/c6cc09624g]。
另一典型花菁基光疗剂IR780,因其能特异性靶向肿瘤细胞线粒体而备受关注。然而,其光稳定性不足严重限制了其临床应用。为此,Zhao等人巧妙地引入了聚集诱导发光(AIE)特性的四苯乙烯(TPE)单元至七甲基花菁IR-780中,合成了IR780-O-TPE。这一创新不仅显著改善了IR-780的光稳定性、细胞吸收能力及靶向效率(图8A),还通过TPE的加入优化了其疏水性,增强了与线粒体膜的相互作用,从而实现了更高效的线粒体靶向(图8B)。在治疗效果上,IR780-O-TPE展现出了更高的细胞毒性,其IC50值在无光照条件下为3.3 μM,而在光照条件下降低至0.3 μM,明显优于IR-780。此外,在4T1肿瘤小鼠模型中,IR780-O-TPE也展示了比IR780更为有效的光热治疗(PTT)反应,标志着花菁治疗剂物理性质的优化,为其在临床光疗中的广泛应用奠定了坚实基础[https://doi.org/10.1021/acsami.0c01715]。 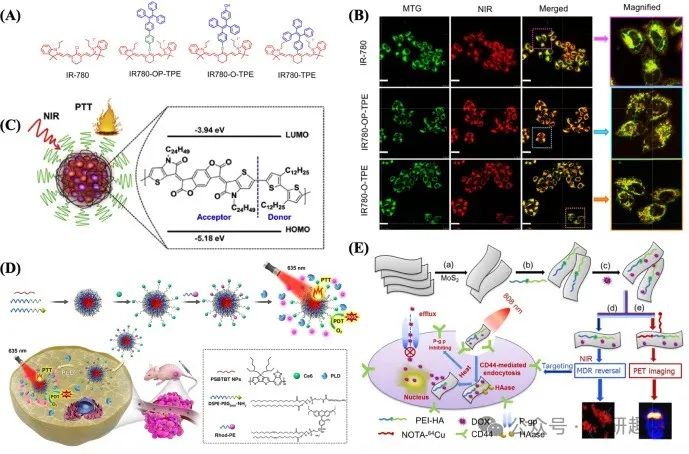 图 8. (A) IR-780 探针的结构。(B) 用于线粒体追踪的 IR-780 探针的细胞器靶向。(C) 用于光热疗法的 NPPBTPBF-BT 的制备示意图。(D) PLD 可激活的肿瘤图像和 PTT/PDT 联合疗法。(E)MoS2-PEI-HA 纳米片作为一种多功能平台,在 PET 成像引导下对 MCF-7-ADR 细胞进行靶向和多重刺激响应治疗。
图 8. (A) IR-780 探针的结构。(B) 用于线粒体追踪的 IR-780 探针的细胞器靶向。(C) 用于光热疗法的 NPPBTPBF-BT 的制备示意图。(D) PLD 可激活的肿瘤图像和 PTT/PDT 联合疗法。(E)MoS2-PEI-HA 纳米片作为一种多功能平台,在 PET 成像引导下对 MCF-7-ADR 细胞进行靶向和多重刺激响应治疗。
目前,梅洛青 540 已被用于临床前模型和美国的一项 I 期临床试验,用于对受白血病或淋巴瘤污染的自体骨髓移植物进行体外净化,并产生了相当大的细胞损伤[https://doi.org/10.1016/s1011-1344(00)00021-x]。然而,氰基 NPs 的优势并不稳定,有关氰基荧光团的光电转换反应的基本机制仍不清楚。
有机半导体聚合物 (SP) NPs
SP纳米颗粒(SP NPs)作为一类先进的有机光学纳米材料,凭借其卓越的吸收系数、优异的光稳定性、良好的生物相容性以及易于表面功能化的特性,在光治疗剂领域展现出巨大潜力。这些纳米颗粒的核心结构通常由SP分子与两亲性聚合物基质精心构建,相较于单独的SP分子,SP NPs在光学性能和生物相容性方面实现了显著提升。
为了深化SP NPs在光疗中的应用深度,Cao等人创新性地开发了有机PBTPBF-BT NPs。这类纳米粒子在1064纳米的近红外-II区域展现出了强大的吸收能力,其光电转换效率(PCE)高达66.4%,标志着光热转换效率的重大突破(图8C)。实验证明,即使在较低的功率密度条件下,PBTPBF-BT NPs也能有效促进肿瘤细胞的消融,同时在肿瘤区域获取的光声(PA)图像中,信号强度在注射后8小时内迅速攀升至峰值,充分展示了其在成像引导光热治疗(PTT)中的巨大应用前景[https://doi.org/10.1016/j.biomaterials.2017.11.016]。
近期,Bao等人在SP NPs的基础上,进一步开发出了一种集生物标记识别与光疗功能于一体的治疗纳米平台——PSBTBT NPs。该平台不仅能够应用于放射生物成像,还能引导协同的光动力治疗(PDT)与光热治疗(PTT),实现了治疗手段的多元化与精准化(图8D)。尤为值得关注的是,该平台巧妙地利用了人类恶性肿瘤中特异性过表达的生物标记物PLD,该标记物能够特异性裂解罗丹明B,从而恢复其荧光,这一机制不仅为肿瘤的诊断提供了可激活的荧光成像手段,还增强了光疗的靶向性,实现了对肿瘤细胞的精准打击[https://doi.org/10.1021/acs.biomac.0c01567]。
尽管聚合物材料在生物医学领域的应用已日趋广泛,但SP NPs对于特定细胞类型(如红细胞、免疫细胞及干细胞)命运与功能的影响机制尚不完全清晰,这要求我们在未来的研究中进一步深入探索,以全面评估并优化SP NPs的生物安全性与治疗效果。
近红外光疗纳米材料——基于光疗的联合治疗
癌症光疗,作为一种前沿的非侵入性治疗手段,正逐渐崭露头角成为极具竞争力的癌症治疗策略之一。然而,该疗法面临若干固有挑战,显著制约了其临床应用的广泛推广。这些挑战主要包括:首先,光的组织穿透深度有限,限制了治疗深度;其次,光动力疗法(PDT)在肿瘤微环境(TME)中的缺氧条件下效果受限;再者,光热疗法(PTT)可能引发的获得性热休克效应亦不容忽视。此外,PTT与PDT过程中产生的高温和活性氧物种(ROS)虽能有效杀伤肿瘤细胞,但也可能对周围健康组织造成不必要的损伤。尽管在动物模型中,光疗对实体瘤的治疗展现出积极成效,但在应对人类肿瘤复发问题上仍显不足。
鉴于此,将癌症光疗与其他治疗模式相结合的策略应运而生,旨在通过优势互补,克服单一疗法的局限性,从而提升整体治疗效果。具体而言,PTT不仅能促进细胞对治疗药物的摄取,还能诱导药物从载体中释放,这一特性为药物输送相关的治疗方法提供了有力支持,并促进了协同疗法的成功实施。同时,PTT产生的高温与PDT生成的ROS能够削弱肿瘤细胞对放疗或化疗的抵抗性,进而增强这些疗法的疗效[115]。此外,光疗还能促进肿瘤组织内血流的加速和氧含量的提升,这对于依赖氧气的化疗和放疗而言,无疑是如虎添翼,显著增强了其治疗效果[116]。
综上所述,将单一的光疗策略与其他癌症治疗方法相结合,不仅能够有效规避各自疗法的不足,还能通过协同作用显著提升癌症治疗的整体效果。这一策略在表2中得到了详尽的阐述,为未来的癌症治疗研究与实践指明了方向。
Table 2. Combinations of phototherapy and various therapeutic modalities in cancer treatment.
| Combination way | Advantages | Disadvantage |
|---|---|---|
| Chemotherapy | Enhancing drug cellular uptake and sensitivity to tumor cells | Inadequate loading efficacy and uncertain doses of synergistic treatment |
| Radiotherapy | Decreasing X-rays harmful to normal cells | Easily injuring normal cells around tumor tissue |
| Immunotherapy | Sparking specific immune responses and enhancing anti-cancer immunity | Low penetration depth |
| Anti-angiogenesis therapy | Increasing sensitivity to tumor blood vessels | Different spatial and temporal characteristics of drugs |
| Sonodynamic | Generating more ROS and improving cytotoxicity | Skin sensitivity |
| Gas therapy | Realizing the targeted release of gas | Neglecting to monitor gas production |
| Gene therapy | Enhancing penetration of cell membranes and promoting gene delivery | The instability of gene carriers |
| Chemodynamic therapy | Accelerating the Fenton reaction | Inconsistency with the reality of tumor models |
| Starvation therapy | Reducing resistance to single nutrients and inhibiting HSPs | Uncertainty between tumor promotion and tumor treatment |
光疗与化疗的结合
在癌症治疗中,传统化疗方法如使用喜树碱、紫杉醇及多柔比星(DOX)等化学药物,常因多药耐药性及特异性不足而面临治疗效果不佳的挑战。为克服这些瓶颈,光疗与化疗的联合策略应运而生,展现出显著优势。光动力疗法(PDT)通过产生活性氧物种(ROS)能够有效抑制活性外流转运体的过度表达,同时,光热疗法(PTT)的实施则增强了细胞膜的通透性,促进了治疗药物如DOX的细胞内蓄积,进而提升了治疗效果。此外,PTT引发的高温环境还能显著提升肿瘤细胞对DNA损伤性化疗药物的敏感性,干扰其DNA修复机制,进一步增强疗效。
针对乳腺癌的化疗耐药性问题,Zhao团队创新性地设计了以聚乙烯亚胺(PEI)和透明质酸(HA)包覆的多功能二硫化钼(MoS2)纳米载体(MoS2-PEI-HA),用于负载化疗药物DOX。该系统中,HA作为靶向分子,能够特异性识别MCF-7-ADR细胞并通过HA酶降解促进DOX的释放。同时,MoS2纳米片诱导的热效应不仅加速了DOX的释放,还有效下调了P糖蛋白的表达,从而逆转了耐药性。实验结果显示,在体外协同化疗与PTT的联合作用下,细胞活力显著降低至2.9%,远低于单一治疗的效果。在动物模型中,经照射后注射DOX@MoS2-PEI-HA的MCF-7-ADR肿瘤抑制率高达96%,明显优于其他对照组[https://doi.org/10.1021/acsami.7b17506]。
为进一步解决实体瘤内部的极端缺氧问题,Cheng团队开发了LA-CAT-CAD@Ce6这一刺激响应型纳米酶原药系统,实现了化疗与PDT的协同增效。该系统中,LA不仅提高了药物在血液循环中的稳定性,还作为活性靶向配体增强了细胞摄取能力。CAD作为DOX的前体,对pH值敏感,能在肿瘤微环境中迅速响应并触发Ce6的释放及ROS的生成。同时,CAT酶在细胞内分解H2O2,原位产生O2,有效缓解了肿瘤缺氧状态。实验数据表明,LA-CAT-CAD@Ce6纳米粒子能够显著抑制肿瘤生长(肿瘤生长抑制率超过90%),甚至在某些情况下实现了肿瘤的完全消融(图9A),展现了其巨大的应用潜力[https://doi.org/10.1016/j.actbio.2020.05.035]。 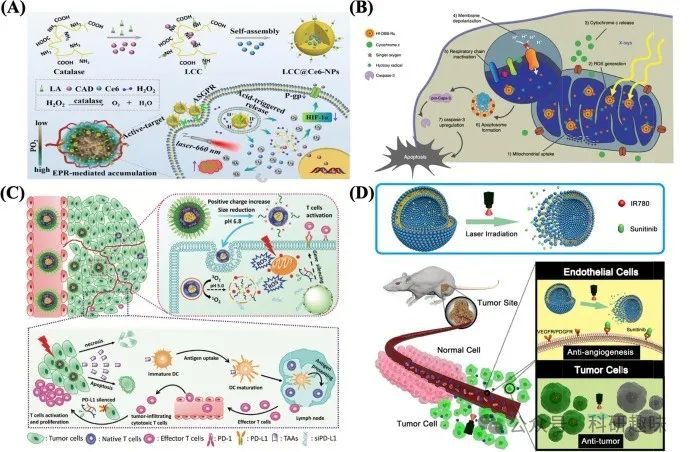 图 9:(A)纳米酶原药纳米颗粒的合成、自组装和体内输送。(B) Hf-DBB-Ru 介导的线粒体靶向 RT-RDT。(C) pH 响应可解离胶束丛介导的体内光动力肿瘤免疫疗法图解。(D) Lip-IR780-Sunitinib 的设计示意图。该给药平台可装载亲水性和亲油性载体,如抗血管生成药物舒尼替尼(亲水性)和光热剂 IR780(亲油性)。
图 9:(A)纳米酶原药纳米颗粒的合成、自组装和体内输送。(B) Hf-DBB-Ru 介导的线粒体靶向 RT-RDT。(C) pH 响应可解离胶束丛介导的体内光动力肿瘤免疫疗法图解。(D) Lip-IR780-Sunitinib 的设计示意图。该给药平台可装载亲水性和亲油性载体,如抗血管生成药物舒尼替尼(亲水性)和光热剂 IR780(亲油性)。
总之,化学光疗是一种抑制肿瘤增殖和复发的新型技术。然而,在广泛应用于临床之前,还必须解决几个问题,包括负荷疗效不足、协同治疗剂量不确定以及不理想的生物相容性。
光疗与放疗的结合
放射治疗,作为肿瘤治疗领域的核心手段之一,广泛采用电离辐射如γ射线、X射线及粒子束,通过诱导氧化应激反应或直接造成DNA损伤来靶向肿瘤细胞,从而达到治疗目的。近年来,放疗与光疗的联合研究逐渐成为热点。光热疗法(PTT)通过其独特的机制,能够缓解肿瘤微环境(TME)的缺氧状况,进而提升肿瘤细胞对X射线或γ射线的敏感性,显著增强治疗效果。相比单一的光疗模式,X射线或γ射线辐射在穿透深度上的优势尤为突出,尤其适用于深部癌症的治疗。因此,光疗与放疗的协同作用展现出了广阔的治疗潜力。
Yong等研究者巧妙地设计了一种多功能WS2量子点(WS2QDs),该纳米平台能够同时实现PTT与放疗的协同治疗效果。此外,WS2QDs还具备双模态成像能力(包括X射线计算机断层扫描和光声成像,PAI),为精准诊断提供了有力支持,实现了在无损监测下的肿瘤完全消除[https://doi.org/10.1021/acsnano.5b05825]。
为进一步提升治疗的靶向性,Ni等团队则专注于线粒体靶向策略,开发了Hf-DBB-Ru复合物。该复合物能够在X射线照射下高效生成羟基自由基(·OH)和单线态氧(¹O₂),以极低的剂量实现光疗与放疗的联合作用,引发线粒体膜去极化、促进细胞凋亡,并有效抑制肿瘤生长(图9B)[https://doi.org/10.1038/s41467-018-06655-7]。
尽管光疗结合放疗为癌症治疗开辟了新的途径,但其临床应用的推广仍面临诸多挑战。一方面,相较于温和的近红外光,高能X射线在治疗过程中可能对肿瘤周围组织细胞造成不必要的损伤。另一方面,放疗与光疗在能量需求及作用时空上的差异性也亟待解决。因此,在未来的研究中,需更加全面地评估这两种疗法的协同效应,并探索优化策略,以确保其在临床上的安全有效应用。
光疗与免疫疗法的结合
免疫疗法,作为癌症治疗领域的一项新兴战略,其核心在于通过激活宿主的免疫记忆机制,促使免疫系统精准识别并清除肿瘤细胞,从而有效预防肿瘤复发。这一领域的突破性成就,如2018年诺贝尔生理学或医学奖的授予,正是基于免疫检查点在癌症治疗中的显著疗效发现。然而,鉴于免疫系统的个体差异性,免疫疗法仅能在少数患者中展现出理想的治疗效果。此外,该疗法可能伴随一系列副作用,包括但不限于造血功能受损、快速产生的耐药性,以及炎症介质的级联放大效应,这些均限制了单一免疫疗法在肿瘤临床治疗中的广泛应用。
值得注意的是,癌症光疗与免疫疗法的结合展现出了强大的协同效应。光疗不仅能够原位暴露肿瘤特异性抗原,激发特异性免疫反应,从而增强机体抗癌免疫力,且具备无创、疗程短的优势。而免疫疗法则能深入清除原发及转移性肿瘤细胞,突破激光探测的局限,有效遏制光疗后的肿瘤复发。Dai等研究者创新性地设计了一种肿瘤酸性响应性胶束纳米复合物,该复合物集成了线粒体靶向光敏剂(PS)与程序性死亡配体1(PD-L1)阻断siRNA,旨在协同增强肿瘤的光疗与免疫治疗。在弱酸性内/溶酶体环境中,基于海绵效应,PD-L1-blockade siRNA与PS得以从纳米复合物中释放(图9C)。实验结果显示,与单一激光治疗组(75%复发率)或PD-L1治疗组(87.5%复发率)相比,联合光照纳米复合体组的复发率显著降低至25%。这一成果揭示了通过抑制PD-L1表达,纳米复合物能在光动力疗法(PDT)中激活辅助性T淋巴细胞,促进细胞因子与干扰素的分泌,进而增强免疫应答,降低免疫耐受性。最终,光疗与免疫疗法的协同作用显著抑制了黑色素瘤的生长,并大幅降低了肿瘤复发率[https://doi.org/10.1002/adfm.201707249]。
近期,日本于2020年9月正式批准了光免疫疗法(Akalux)用于治疗复发性头颈部癌症,该疗法结合了抗EGFR抗体(西妥昔单抗)与光敏剂IR700(RM1929/ASP1929)。在一项跨国II期临床试验中,共纳入39名患者,结果显示治疗有效率达43.3%(其中完全缓解率为13.3%,部分缓解率为30.0%),疗效令人鼓舞。目前,美国食品药品监督管理局(FDA)正积极推进Akalux的全球III期临床试验(ClinicalTrials.gov标识符:NCT03769506),以进一步验证其疗效与安全性[https://doi.org/10.1093/intimm/dxaa037]。
尽管光免疫疗法展现出诸多优势,但其发展仍面临诸多挑战:首先,癌症光疗受限于近红外光的有限穿透深度,限制了光疗诱导免疫疗法的广泛应用;其次,需精确调控光疗诱导的免疫反应强度与可控性;最后,光免疫疗法的内在机制尚需深入探索,以优化治疗效果并减少潜在风险。
光疗与抗血管生成疗法的结合
抗血管生成疗法,作为一种精准的医疗策略,其核心在于抑制血管内皮生长因子(VEGF)的过度表达,进而诱导血管内皮细胞的程序性死亡(凋亡),最终遏制肿瘤的生长与扩张。自1994年起,美国食品及药物管理局(FDA)便确立了抗血管生成疗法作为辅助性治疗手段的地位,旨在减少癌症的复发与远端转移风险。然而,单一的抗血管生成疗法在多数情况下难以完全遏制肿瘤的发展,这促使科学家们探索更加高效的联合治疗方案。其中,癌症光疗与抗血管生成疗法的结合尤为引人注目。
这一联合疗法的优势在于,抗血管生成药物能够显著降低肿瘤组织内部的间质压力,从而优化药物递送环境,提升治疗效果。同时,在光疗过程中,肿瘤血管因其异常的生理结构对激光照射表现出更高的敏感性,这为光疗的精准打击提供了有利条件[132]。
近期,一系列关于癌症光疗与抗血管生成疗法协同作用的研究取得了显著进展。例如,Yang等人设计了一种创新的双功能给药系统——Lip-IR780-Sunitinib,该系统巧妙地将抗血管生成药物舒尼替尼与近红外染料IR780相结合。在激光照射下,该系统能够迅速分解,释放并激活舒尼替尼,有效阻断肿瘤血管生成;同时,光敏剂IR780则通过产生高热直接消融癌细胞。这一体外与体内实验均证实了该系统在协同抗血管生成与光热疗法(PTT)方面的显著疗效[https://doi.org/10.1016/j.nano.2018.06.011]。
此外,Zou等人也贡献了一项重要研究成果,他们成功地将有机半导体分子T8IC与抗血管生成药物索拉非尼结合,制备出了一种名为TS NPs的纳米粒子。T8IC因其卓越的近红外-II区吸收特性,不仅可用于荧光成像引导下的精准治疗,还显著增强了光疗效果。而TS NPs则展现出了高光电转换效率(PCE,约32.47%)、强大的活性氧(ROS)生成能力以及卓越的抗血管生成能力。这一创新策略在协同治疗中取得了令人瞩目的效果,为癌症治疗提供了新的思路与方向(图10A)[https://doi.org/10.1039/d1tb00209k]。 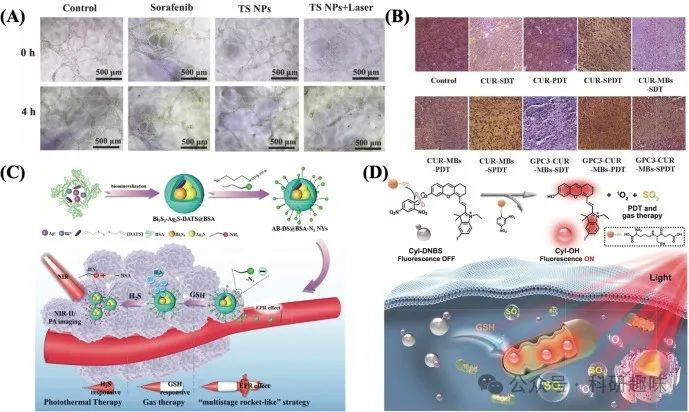 图 10:(A)体外 HUVEC 管形成和抗血管生成效应(NPs 40 毫克/毫升-1,激光 5 分钟)。(B) 治疗 14 天后用不同处理方法染色的肿瘤切片的 H&E 图像。(C) AB-DS@BSA-N3 NYs 增强肿瘤靶向积累的示意图及相应的抗癌机制。(D) CyI-DNBS 用于联合光透射疗法和二氧化硫气体疗法的示意图。
图 10:(A)体外 HUVEC 管形成和抗血管生成效应(NPs 40 毫克/毫升-1,激光 5 分钟)。(B) 治疗 14 天后用不同处理方法染色的肿瘤切片的 H&E 图像。(C) AB-DS@BSA-N3 NYs 增强肿瘤靶向积累的示意图及相应的抗癌机制。(D) CyI-DNBS 用于联合光透射疗法和二氧化硫气体疗法的示意图。
癌症光疗和抗血管生成疗法的联合治疗为癌症治疗提供了一种前景广阔的方法,但不同的药物具有特殊的时空特征。光疗可以在照射后立即通过 1O2 杀死肿瘤细胞,但通常需要较长时间的抗血管生成治疗才能奏效。
光疗和声动力疗法的结合
SDT(声动力疗法)作为一种创新的癌症治疗手段,依赖于低强度超声波来激活声敏化剂,进而触发活性氧(ROS)的生成,实现对肿瘤细胞的精准破坏。相较于传统肿瘤光疗受限于穿透深度的不足,SDT凭借其独特的超声空化效应,能够深入肿瘤组织内部,有效破坏肿瘤血管并消融肿瘤细胞,同时最大限度地减少对周围正常组织的损伤。
在治疗效果方面,声波光动力疗法(SPDT)相较于单一的SDT或PDT展现出更为显著的肿瘤抑制作用。这得益于SPDT在较低剂量下即可诱导大量ROS的产生,从而减轻治疗副作用并提升疗效。基础研究表明,SPDT在乳腺癌、肝癌、胶质瘤及皮肤鳞状细胞癌等多种癌症模型中均表现出色。
Zhu及其团队的研究进一步推动了SPDT在肝癌治疗中的应用。他们设计了一种以glypican-3为靶点,并负载有姜黄素的微气泡(GPC3-CUR-MBs)。在超声作用下,该微气泡不仅增强了细胞膜的通透性,促进了声敏化剂的快速积累,还显著提升了PDT的治疗效果。通过H&E染色分析(图10B),SPDT组展现出卓越的抗肿瘤效果,且未观察到明显的副作用,这为其临床应用提供了有力支持[https://doi.org/10.1016/j.colsurfb.2020.111358]。
此外,Nomikou等人则开发出了一种结合临床批准的近红外制剂血卟啉(HP)和吲哚菁绿(ICG)的纳米平台(HP + ICG NPs)。在超声与激光的双重刺激下,该平台能够高效产生ROS,并实现荧光成像引导下的肿瘤抑制。这一研究成果不仅展示了SPDT在癌症治疗中的多功能性,还为开发新型癌症治疗策略提供了重要参考[https://doi.org/10.1016/j.actbio.2016.11.031]。
然而,值得注意的是,目前报道的多数声波敏化剂在皮肤敏感性方面与光敏剂(PS)相似,这在一定程度上限制了其在临床癌症治疗中的广泛应用。因此,未来研究需致力于开发具有更低皮肤敏感性的声波敏化剂,以推动SPDT在癌症治疗领域的进一步发展。
光疗和气体治疗的结合
近年来,气体治疗(Gas Therapy, GAT)作为一种新兴的抗癌策略,利用硫化氢(H2S)、一氧化碳(CO)、一氧化氮(NO)、二氧化硫(SO2)及氢气(H2)等生物活性气体,在调控细胞信号转导、抑制癌症增殖、侵袭、转移及肿瘤血管生成方面展现出巨大潜力。这些气体分子作为生理平衡的关键调节者,在特定浓度下能有效穿透肿瘤组织,特异性破坏癌细胞,同时保持对正常组织的低毒性。然而,单一气体疗法的疗效受限于气体浓度调控、靶向递送及释放控制,难以单独实现肿瘤复发的有效抑制。
为克服这一挑战,研究者们探索了气体疗法与其他治疗手段的联合应用。You等人通过构建Au@SiO2纳米结构,并引入热休克蛋白抑制剂2-苯基乙炔磺酰胺(PES),实现了NO的温控释放与低温光热疗法(PTT)的协同,展示了按需气体释放与热触发的双重优势[https://doi.org/10.1021/acsbiomaterials.9b01771]。另一项研究中,Zheng等人设计的Bi2S3-Ag2S-DATS@BSA-N3 NYs纳米系统,利用肿瘤微环境(TME)激活的连续级联反应,实现了近红外二区荧光/光声成像(NIR-II FI/PAI)引导下的PTT与GAT协同治疗。该系统通过DATS与肿瘤过表达谷胱甘肽(GSH)的反应加速H2S生成,不仅触发了GAT,还促进了纳米粒子的肿瘤特异性聚集,显著提升了治疗效果[https://doi.org/10.1039/d0nr02543g]。
氢气(H2)作为一种独特的还原性气体,能够选择性地中和肿瘤内过量的羟自由基,打破氧化还原平衡,诱导氧化还原应激介导的细胞损伤。Wang等人开发的PdH@MnO2/Ce6@HA(PHMCH)卵黄壳纳米平台,集成了氢靶向递送、可控氢释放及高效光催化性能,实现了缺氧调节、多模态成像与GAT/PTT/光动力疗法(PDT)的协同作用。该平台的异质结构有效阻止了光生电子-空穴对的复合,实现了O2与ROS的时空同步生成,极大增强了PDT效果[https://doi.org/10.1021/acsnano.1c10450]。
此外,Wang等人还利用肿瘤细胞中过表达的谷胱甘肽设计了智能光敏剂CyI-DNBS,实现了PDT与GAT的协同治疗。谷胱甘肽浓度的升高促进了活性光敏剂CyI-OH的释放及SO2的生成,展现了体内抗癌的显著协同效果[https://doi.org/10.1002/adhm.202102017]。
然而,当前光疗与气体疗法的联合应用中,光声成像技术主要聚焦于气体载体或原药的定位,而忽视了对气体产生过程的实时监测。未来研究应聚焦于开发能够直接监测气体生成与分布的新型成像技术,以进一步优化治疗策略,实现光疗与气体疗法的最佳组合效果。
光疗与基因治疗的结合
近年来,光疗与基因治疗相结合的新型癌症治疗策略引起了科学界的广泛关注。基因治疗,作为一种前沿的生物医学技术,利用小干扰RNA(siRNA)作为工具,通过下调或替换致病突变基因,精准调控蛋白质表达水平,从而实现对多种疾病的有效治疗。这一策略在癌症治疗中展现出巨大潜力,尤其是当其与光疗相结合时,能够产生协同增效的治疗效果。
光反应纳米平台作为基因编辑分子的载体,其内部机制在促进癌症抑制方面发挥了关键作用。特别是,通过光疗产生的高热效应,能够显著增强纳米平台对细胞膜的穿透能力,进而促进基因编辑分子如siRNA的高效传递。Wang等人巧妙设计了聚乙烯亚胺(PEI)修饰的黑磷(BP)纳米片(BP-PEI),作为一种创新的基因纳米平台,用于siRNA的递送。该纳米平台不仅能够有效负载并保护siRNA免受酶解破坏,还显著提升了癌细胞对siRNA的摄取效率。在光疗与基因治疗的协同作用下,BP-PEI纳米平台实现了对癌细胞的双重打击,显著提高了治疗效果(图11A)[https://doi.org/10.1039/c8cc00931g]。
此外,光疗与基因治疗的联合策略不仅局限于癌症治疗领域,还展现出在治疗光化性咽颊炎、皮肤病等多种疾病方面的广阔前景[151]。然而,要实现这一策略在临床上的广泛应用,仍需解决一些挑战,如基因载体在体内的稳定性问题以及光疗剂在肿瘤组织中的有效浓度维持等。未来研究应聚焦于优化纳米载体的设计,提高其生物相容性和靶向性,同时探索更加高效的光疗策略,以确保光疗与基因治疗能够发挥最大的协同治疗效果。 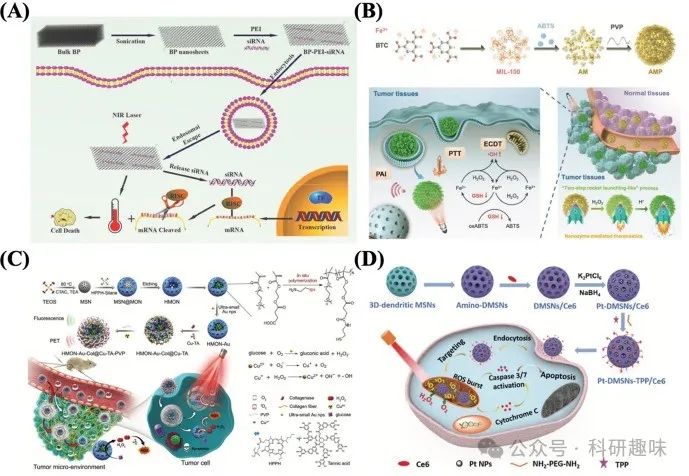 图 11.(A) 基于 BP 纳米片的 siRNA 递送系统对癌细胞进行协同光热和基因治疗的示意图。(B) AMP NRs 用于肿瘤微环境激活的纳米酶介导的热疗示意图。(C 原位聚合中空介孔有机硅生物催化纳米反应器用于光动力(PDT)/化学动力(CDT)协同治疗的过程示意图。(D)基于三维树枝状 MSNs 系统的合成及其在增强光动力疗法中的应用示意图。
图 11.(A) 基于 BP 纳米片的 siRNA 递送系统对癌细胞进行协同光热和基因治疗的示意图。(B) AMP NRs 用于肿瘤微环境激活的纳米酶介导的热疗示意图。(C 原位聚合中空介孔有机硅生物催化纳米反应器用于光动力(PDT)/化学动力(CDT)协同治疗的过程示意图。(D)基于三维树枝状 MSNs 系统的合成及其在增强光动力疗法中的应用示意图。
光疗和化学动力学疗法的结合
在癌症治疗领域,基于活性氧(ROS)的化学动力学疗法(CDT)作为一种创新策略,其核心在于利用金属基芬顿或类芬顿催化剂,将内源性过氧化氢(H2O2)高效转化为高毒性的羟自由基(•OH),这一过程展现了催化剂的高灵敏度和卓越的选择性。值得注意的是,光热疗法(PTT)诱导的肿瘤局部温升能够显著加速芬顿反应动力学,进而增强抗癌疗效。此外,将光动力疗法(PDT)与CDT联合应用,可产生显著的ROS协同效应,极大提升癌症治疗的效率。
Liu等研究者巧妙设计了一种2,2′-叠氮双(3-乙基苯并噻唑啉-6-磺酸)纳米反应器(AMP NRs),该反应器能够在肿瘤微环境(TME)中丰富的H2O2存在下被激活,展现出优异的光声成像(PAI)和光热治疗(PTT)性能。尤为重要的是,AMP NRs不仅能在PTT过程中同步产生•OH,还能有效耗竭细胞内谷胱甘肽(GSH),通过PTT/CDT的协同作用实现了显著的治疗效果(如图11B所示)[https://doi.org/10.1002/adma.201902885]。
另一方面,Li等人则开发了一种聚合空心介孔有机硅纳米粒子(HMON-Au-Col@Cu-TAVPP NPs),该纳米平台集成了PDT与CDT的优势,显著增强了ROS介导的胰腺导管腺癌治疗效果,展示了卓越的肿瘤消融能力且无复发迹象(如图11C所示)[https://doi.org/10.1002/adfm.201907716]。
癌症光疗与CDT的联合策略,通过克服单一疗法的局限性,显著提升了肿瘤消除效果,推动了PTT/CDT治疗药物在生物医学领域的深入发展。然而,值得注意的是,当前文献多基于简化的肿瘤模型,与复杂多变的临床实际存在差距,因此尚未有涉及PTT/CDT协同作用的临床试验报道。为实现其临床应用,未来的研究应聚焦于纳米药物的生物安全性评估、药物负载的精准调控以及规模化生产工艺的优化,以确保其在治疗过程中的有效性与安全性。
光疗和饥饿疗法的结合
饥饿疗法(ST),作为一种前沿的癌症治疗策略,其核心机制在于通过精确调控以中断肿瘤细胞的关键营养与能量供给链,诱导其新陈代谢失衡,最终迫使肿瘤细胞因能量枯竭而凋亡。鉴于肿瘤细胞相较于正常组织对营养与能量的高度依赖性,ST通过限制关键代谢通路或剥夺葡萄糖等关键底物,能够有效抑制线粒体有氧呼吸,阻断NADPH的生成路径,干扰磷酸戊糖途径,进而遏制肿瘤的生长与发展。
将ST与光疗策略相结合,旨在通过多模态治疗效应防止肿瘤细胞利用其他代谢途径进行补偿性适应,减少单一营养剥夺治疗下的耐药性发展,从而显著提升整体治疗效果[159]。特别地,葡萄糖氧化酶(GOx)作为催化葡萄糖氧化为葡萄糖酸和H2O2的关键酶,被广泛用于构建酸性及缺氧的肿瘤微环境(TME)。基于GOx的纳米复合材料通过级联反应机制,不仅增强了治疗效率,还展现出良好的协同潜力。例如,You等人设计的双酶(GOx与过氧化氢酶)功能化核壳纳米马达(UTZCG@ZIF),利用过氧化氢酶促进GOx催化反应及内源性H2O2的分解,同时生成的O2既促进了光动力疗法(PDT)中1O2的产生,又加速了GOx触发的葡萄糖降解过程,通过双重酶驱动的级联反应极大提升了PDT与ST的协同治疗效果[https://doi.org/10.1016/j.apmt.2019.07.008]。
此外,针对肿瘤中热休克蛋白(HSPs)依赖ATP进行生物合成,进而影响光热疗法(PTT)疗效的问题,ST提供了一种创新的解决方案,即通过非HSP抑制剂途径减少HSPs水平,以增强PTT的协同效果。Dai等人通过将具有卓越近红外二区荧光成像(NIR-II FI)性能及PTT效能的半导体聚合物与糖酵解抑制剂2-脱氧-D-葡萄糖共同封装于叶酸修饰的脂质体中,实现了NIR-II光热效应触发的药物释放。这一策略不仅削减了肿瘤细胞的能量储备,降低了ATP水平,还阻断了HSPs的生成,显著增强了肿瘤对PTT的热敏感性[https://doi.org/10.1016/j.biomaterials.2021.120935]。
参考文献
Zhang, Y.; Zhang, Y.; Zhang, G.; Wu, J.; Wang, L.; Dong, Z.; Zheng, Y.; Huang, Q.; Zou, M.; Liao, R.; Wang, F.; Liang, P. Recent Advances and Clinical Challenges of Phototherapeutic Nanoparticles in Cancer Monotherapy or Combination Therapy. Coordination Chemistry Reviews 2024, 518, 216069. https://doi.org/10.1016/j.ccr.2024.216069.